高中化学《学科知识与能力》考试重点汇总(一)
2014-11-08 | 作者: afanda | 来源: 未知 | 共关注:次
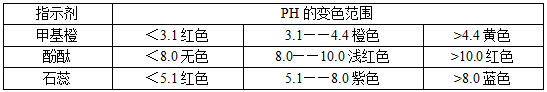
1、常用酸、碱指示剂的变色范围:
2、在惰性电极上,各种离子的放电顺序:
阴极(夺电子的能力):Au3+ >Ag+>Hg2+ >Cu2+ >Pb2+ >Fa2+ >Zn2+ >H+ >Al3+>Mg2+ >Na+ >Ca2+ >K+
阳极(失电子的能力):S2- >I- >Br– >Cl- >OH- >含氧酸根
注意:若用金属作阳极,电解时阳极本身发生氧化还原反应(Pt、Au除外)
3、双水解离子方程式的书写:
(1)左边写出水解的离子,右边写出水解产物;
(2)配平:在左边先配平电荷,再在右边配平其它原子;
(3)H、O不平则在那边加水。
例:当Na2CO3与AlCl3溶液混和时: 3 CO32- + 2Al3+ + 3H2O = 2Al(OH)3↓ + 3CO2↑
4、写电解总反应方程式的方法:
(1)分析:反应物、生成物是什么;(2)配平。
例:电解KCl溶液:2KCl + 2H2O == H2↑+ Cl2↑+ 2KOH
5、将一个化学反应方程式分写成二个电极反应的方法:
(1)按电子得失写出二个半反应式;(2)再考虑反应时的环境(酸性或碱性);(3)使二边的原子数、电荷数相等。
例:写出作为原电池(放电)时的电极反应。
写出二个半反应: Pb –2e- → PbSO4 PbO2 +2e- → PbSO4
分析:在酸性环境中,补满其它原子,应为:
负极:Pb + SO42- -2e- = PbSO4
正极: PbO2 + 4H+ + SO42- +2e- = PbSO4 + 2H2O
注意:当是充电时则是电解,电极反应则为以上电极反应的倒转:
为: 阴极:PbSO4 +2e- = Pb + SO42- 阳极:PbSO4 + 2H2O -2e- = PbO2 + 4H+ + SO42-
6、在解计算题中常用到的恒等:原子恒等、离子恒等、电子恒等、电荷恒等、电量恒等。用到的方法有:质量守恒、差量法、归一法、极限法、关系法、十字交法 和估算法。(非氧化还原反应:原子守恒、电荷 平衡、物料平衡用得多,氧化还原反应:电子守恒用得多)
7、电子层结构相同的离子,核电荷数越多,离子半径越小。
8、晶体的熔点:原子晶体 >离子晶体 >分子晶体
中学学到的原子晶体有: Si、SiC 、SiO2和金刚石。
原子晶体的熔点的比较是以原子半径为依据的: 金刚石 > SiC > Si (因为原子半径:Si> C> O)。
9、分子晶体的熔、沸点:组成和结构相似的物质,分子量越大熔、沸点越高。
10、胶体的带电:一般说来,金属氢氧化物、金属氧化物的胶体粒子带正电,非金属氧化物、金属硫化物的胶体粒子带负电。
11、含有Fe3+的溶液一般呈酸性。
12、能形成氢键的物质:H2O 、NH3 、HF、CH3CH2OH 。
13、氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:1.84g/cm3。
14、离子是否共存:(1)是否有沉淀生成、气体放出;(2)是否有弱电解质生成;(3)是否发生氧化还原反应;(4)是否生成络离子[Fe(SCN)2、Fe(SCN)3、Ag(NH3)+、[Cu(NH3)4]2+ 等];(5)是否发生双水解。
15、气体溶解度:在一定的压强和温度下,1体积水里达到饱和状态时气体的体积。
>>优惠活动:
自考本科优惠:培训课程(含全部科目)仅需3980元!还赠送一套价值500元的纸质教材!
成人高考优惠:成考大专+自考本科,两者同时报读,学费再减1000元!






