高中化学《学科知识与能力》考试重点汇总(九)
2014-11-08 | 作者: afanda | 来源: 未知 | 共关注:次
一、"五同的区别"
同位素:相同的中子数,不同的质子数,是微观微粒。
同素异形体:同一种元素不同的单质,是宏观物质。
同分异构体:相同的分子式,不同的结构。
同系物:组成的元素相同,同一类的有机物,相差一个或若干个的CH2。
同一种的物质:氯仿和三氯甲烷,异丁烷和2-甲基丙烷等。
二、原电池
1.原电池形成三条件: “三看”。
先看电极:两极为导体且活泼性不同;再看溶液:两极插入电解质溶液中;三看回路:形成闭合回路或两极接触。
2.原理三要点:(1) 相对活泼金属作负极,失去电子,发生氧化反应;(2) 相对不活泼金属(或碳)作正极,得到电子,发生还原反应;(3) 导线中(接触)有电流通过,使化学能转变为电能。
3.原电池:把化学能转变为电能的装置。
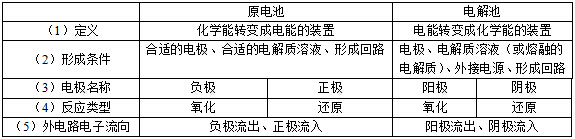
4.原电池与电解池的比较
三、等效平衡问题及解题思路
1.等效平衡的含义:在一定条件(定温、定容或定温、定压)下,只是起始加入情况不同的同一可逆反应达到平衡后,任何相同组分的分数(体积、物质的量)均相同,这样的化学平衡互称等效平衡。
2.等效平衡的分类
(1)定温(T)、定容(V)条件下的等效平衡
Ⅰ类:对于一般可逆反应,在定T、V条件下,只改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡式左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。
Ⅱ类:在定T、V情况下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
(2)定T、P下的等效平衡
在T、P相同的条件下,改变起始加入情况,只要按化学计量数换算成平衡式左右两边同一边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。
>>优惠活动:
自考本科优惠:培训课程(含全部科目)仅需3980元!还赠送一套价值500元的纸质教材!
成人高考优惠:成考大专+自考本科,两者同时报读,学费再减1000元!






